- Safety workbench
Thomas Hinrichs, Michael Klein
Stellungnahme zum neuen Anhang 1 des GMP Leitfadens
Einsatz von Sicherheitswerkbänken für die aseptische Zubereitung applikationsfertiger Parenteralia in Apotheken und Arzneimittel- Herstellungsbetrieben
Vorgaben im neuen Anhang 1 des GMP-Leitfadens [1] zur Nutzung von Mini-Containments haben die Frage aufgeworfen, ob Sicherheitswerkbänke weiterhin für die aseptische, patientenindividuelle Zubereitung von Arzneimitteln eingesetzt werden dürfen.
Die Bedenken beruhen vor allem auf folgenden Aussagen:
„Restricted Access Barrier Systems (RABS) or isolators are beneficial in assuring required conditions and minimizing microbial contamination associated with direct human interventions in the critical zone.“
„Where possible, the use of equipment such as RABS, isolators or other systems, should be considered in order to reduce the need for critical interventions into grade A and to minimize the risk of contamination.“
Alternative Barrieresysteme werden im Anhang 1 nicht ausdrücklich benannt. Bedeutet dies, dass Apotheken und Herstellungsbetriebe zukünftig auf RABS oder Isolatoren umsteigen müssen, um weiterhin den Anforderungen an die Zubereitung applikationsfertiger Parenteralia zu entsprechen?
Entscheidungskriterien
Produktschutz: Erfolgt die Zubereitung im Rahmen des sogenannten üblichen Apothekenbetriebs, sind die Produktschutzanforderungen aus § 35 der ApBetrO [2] umzusetzen. Mit welcher Barrieretechnologie die darin geforderte Reinraumklasse A erreicht wird, ist nicht festgelegt. Der PIC/S Guide PE 010-4 [3] empfiehlt diesbezüglich den Einsatz von Laminar Flow-Werkbänken (bzw. biologischen Sicherheitswerkbänken) oder pharmazeutischen Isolatoren. Auch nach Auffassung der Bundesapothekerkammer (BAK) sollte das benötigte Containment in dieser Form umgesetzt werden [4]. Der Bundesverband Deutscher Krankenhausapotheker (ADKA) benennt ebenfalls Sicherheitswerkbänke und Isolatoren als geeignete Laminar Air Flow-Systeme, führt in der entsprechenden Leitlinie [5] aber auch RABS auf. Bei der Herstellung von Arzneimitteln in Betrieben mit Herstellerlaubnis nach § 13 AMG [6] müssen die Vorgaben des GMP-Leitfadens umfassend beachtet werden. Dies bedeutet jedoch nicht, dass der Einsatz von RABS oder Isolatoren der einzig gangbare Weg wäre. Auch alternative Lösungen sind möglich, sofern diese angemessen begründet und einer Risikobewertung unterzogen werden. Im Anhang 1 heißt es dazu: „Any alternative approaches to the use of RABS or isolators should be justified.“
Arbeitsschutz: Sollen Parenteralia mit toxischen Eigenschaften (z. B. solche mit CMR-Potenzial) zubereitet werden, sind neben Maßnahmen zur Wahrung der Produktintegrität auch solche zum Schutz des Herstellungspersonals erforderlich. Der neue Anhang 1 lässt für Reinräume Abweichungen von Luftzufuhr und Raumdruck zu, sofern der Austrag gesundheitsgefährdender Materialien aus dem Containment verhindert werden muss. In diesem Fall und nach Anwendung spezieller Risikokontrollmaßnahmen ist es erlaubt, einen im Unterdruck betriebenen Isolator einzusetzen. Eindeutige Vorgaben in Bezug auf die Verwendung technischer Einrichtungen ergeben sich aus dem Arbeitsschutzrecht: Nach TRGS 525 [7] ist „jedes Zubereiten [von CMR-Arzneimitteln] in einer geeigneten Sicherheitswerkbank gemäß DIN 12980 durchzuführen.“ Einrichtungen, die eine gleichwertige Sicherheit bieten, können ebenfalls eingesetzt werden. Eine Rückführung der Fortluft in den umgebenden Raum ist grundsätzlich nicht zulässig. Diese Vorgaben werden auch in den o. g. pharmazeutischen Leitlinien wiedergegeben. RABS und Isolatoren, die über Öffnungen zur Umgebung verfügen und/oder im Überdruck betrieben werden, stellen keine geeigneten Arbeitsschutzeinrichtungen dar.
Praktikabilität und Ergonomie
Ein weiterer wichtiger Aspekt bei der Wahl des richtigen Containments ergibt sich aus dessen praktischer Eignung in Bezug auf die durchzuführenden Tätigkeiten. Aufgrund der Variabilität der herzustellenden Parenteralia beansprucht ein Großteil ihrer Zubereitung immer noch Handarbeit. Ein dafür vorgesehenes Containment sollte deshalb so ausgelegt sein, dass es Produkt und Personal sicher vor Kontaminationen schützt, gleichzeitig aber eine ergonomische und auf die Arbeitspraxis ausgerichtete Durchführung der Arbeitsschritte unterstützt. RABS und Isolatoren – vor allem solche, deren Gestaltung sich an industriellen Verfahren orientiert – sind deshalb nur mit Einschränkungen für eine auf Handarbeit ausgerichtete Herstellung geeignet. Sicherheitswerkbänke und Isolatoren für Zytostatika nach DIN 12980 [8] sind dagegen speziell für diesen Zweck konzipiert. Der weitgehend freie Eingriff in den Zubereitungsbereich einer Sicherheitswerkbank erfordert allerdings eine entsprechend angepasste und validierte Arbeitsweise, um Kontaminationsverschleppungen (vor allem beim Materialtransfer) zuverlässig zu verhindern.
Unsere Einschätzung
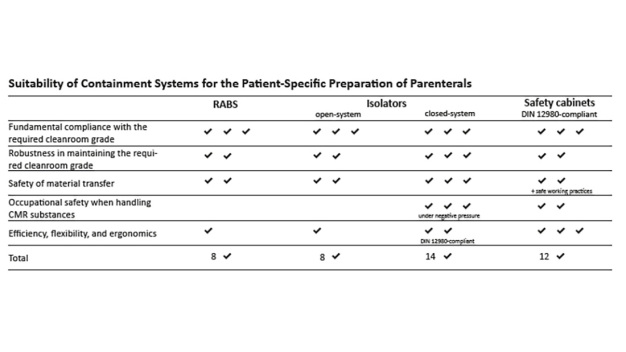
Die Zubereitung patientenindividueller Parenteralia stellt aufgrund ihres hohen Bedarfs an händischen Arbeitsschritten eine besondere Form der Arzneimittelherstellung dar. Dies ist bei der Auswahl eines geeigneten Containments zu berücksichtigen.Auch wenn Sicherheitswerkbänke im neuen GMP-Anhang 1 nicht explizit als Barrieresystem aufgeführt werden, gelten sie in den aktuell gültigen Regelwerken als anerkanntes Mittel, um den spezifischen Anforderungen an eine sterile Zubereitung von Individualarzneimitteln gerecht zu werden. Dies gilt insbesondere dann, wenn neben Anforderungen an den Produktschutz auch solche an den Arbeitsschutz beachtet werden müssen (Zubereitung von CMR-Parenteralia). Sicherheitswerkbänke bieten unter diesen Herstellungsbedingungen einen ausgewogenen Kompromiss aus Schutzwirkung und Ergonomie, mit dem – stärker als bei anderen Containments – die Notwendigkeit manueller Tätigkeiten berücksichtigt werden kann (s. Tabelle). Die Festlegung aller Leistungsanforderungen in einer eigenen Prüfnorm und die Verpflichtung der Hersteller, ihre als „Sicherheitswerkbänke nach DIN 12980“ angebotenen Geräte normgerecht prüfen zu müssen, gibt dem Anwender die Sicherheit, eine in allen Belangen zuverlässige Containmentlösung einzusetzen. Diese lässt sich, wie vom Anhang 1 gefordert, auf Grundlage der Herstellungsbedingungen sowie des nachweislich gebotenen Schutzniveaus begründen. Sicherheitswerkbänke nach DIN 12980 sind RABS und offenen Isolatoren bei der Zubereitung patientenindividueller Arzneimittel überlegen und stellen somit eine sichere, bewährte und häufig praktikablere Alternative zu geschlossen Isolatoren (nach DIN 12980) dar. Zur Wahrung der Schutzfunktionen ist allerdings besonders beim Einsatz von Sicherheitswerkbänken auf eine nachweislich geeignete Arbeitsweise des Personals zu achten.
Literatur
[1] European Commission: The Rules Governing Medicinal Products in the European Union. Volume 4. EUGuidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use. Annex 1. Manufacture of Sterile Medicinal Products. Stand: 22.08.2022. https://health. ec.europa.eu/medicinal-products/eudralex/eudralex-volume-4_en.
[2] Bundesministerium der Justiz und für Verbraucherschutz: Verordnung über den Betrieb von Apothe- ken (Apothekenbetriebsordnung - ApBetrO). Stand: 12.12.2023. https://www.gesetze-im-internet. de/apobetro_1987/.
[3] Pharmaceutical Inspection Convention, Pharmaceutical Inspection Co-operation Scheme: PIC/S Guide to Good Practices for the Preparation of Medicinal Products in Healthcare Establishments. PE 010-4. Stand: 01.03.2014. https://picscheme.org/en/publications.
[4] Bundesapothekerkammer (BAK): Kommentar zur Leitlinie der Bundesapothekerkammer zur
Qualitätssicherung. Aseptische Herstellung und Prüfung applikationsfertiger Parenteralia. Stand: 14.05.2024. https://www.abda.de/fuer-apotheker/qualitaetssicherung/leitlinien/
leitlinien-und-arbeitshilfen/herstellung/.
[5] Bundesverband Deutscher Krankenhausapotheker (ADKA): ADKA-Leitlinie für die Aseptische Zube reitung und Prüfung applikationsfertiger Parenteralia in der Krankenhausapotheke. Stand: 03/2025. https://www.adka.de/wissenschaft/standards-leitlinien.
[6] Bundesministerium der Justiz und für Verbraucherschutz: Gesetz über den Verkehr mit Arzneimitteln (Arzneimittelgesetz - AMG). Strand: 23.10.2024. https://www.gesetze-im-internet.de/amg_1976/.
[7] Bundesanstalt für Arbeitsschutz und Arbeitsmedizin (BAuA): TRGS 525. Gefahrstoffe in Einrichtungen der medizinischen Versorgung. Stand: 09/2024. https://www.baua.de/DE/Angebote/Regelwerk/ TRGS/TRGS-525.
[8] DIN Media: DIN 12980:2017-05. Laboreinrichtungen - Sicherheitswerkbänke und Isolatoren für Zytostatika und sonstige CMR-Arzneimittel. Stand: 05/2017. https://www.dinmedia.de/de/norm/din- 12980/272714933.
![]()
Berner International GmbH
Werner-von-Siemens-Straße 19
25337 Elmshorn
Germany
Phone: +49 4121 43560
Fax: +49 4121 435620
email: info@berner-safety.de
Internet: https://www.berner-safety.de