Oguz Özkeser
Sichere und effektive Desinfektion von sterilen Einrichtungen über die Luft
Bei der Reinraumdesinfektion handelt es sich um einen Routinevorgang in sterilen pharmazeutischen Produktionseinrichtungen. Neben einer vorgegebenen täglichen Low-Level-Desinfektion fordert die FDA (1) ein schlüssiges Desinfektionsprogramm, das auch die regelmäßige Anwendung eines sporiziden Desinfektionsmittels gemäß eines schriftlich niedergelegten Plans vorsieht. Darüber hinaus besagt die United States Pharmacopeia (USP) 29 NF-24, dass die einzig wirksamen sporiziden Desinfektionsmittel Aldehyde, Bleiche, Ozon, Wasserstoffperoxid und Peressigsäure sind.
Tatsächlich können nur wenige dieser Chemikalien eingesetzt werden, da sie entweder eine toxische, karzinogene und/oder eine mutagene Wirkung (Aldehyde, Bleiche, Ozon) haben oder in den hohen Konzentrationen, die für eine effektive sporizide Wirkung vonnöten sind, gefährlich sind. Peressigsäure ist eine der wenigen sporiziden Technologien, die diese Aufgabe sicher und effektiv erfüllt. Der wesentliche Grund hierfür besteht darin, dass Peressigsäure (PES) bereits in sehr geringen Konzentrationen (weniger als 1%) ein wirksames Sporizid ist.
Die Anwendung eines Kaltdesinfektionsmittels
Der Begriff "Kaltdesinfektionsmittel" wird heute in Einrichtungen der pharmazeutischen Industrie immer gebräuchlicher. Gemäß USP ist ein "Kaltdesinfektionsmittel" für eine vollständige Zerstörung sämtlichen mikrobiologischen Lebens zugelassen. Diese Art Wirkung der Chemikalie geht über die eines einfachen Sporizids hinaus.
Kaltdesinfektionsmittel wie Actril®- und Minncare® Cold Sterilants (Medivators) sind sehr wirksame Bakterizide, Fungizide, Mycobakterizide, Sporizide und Viruzide. Der Einsatz der Peressigsäuren- (PES-) Technologie und ihrer Rohmaterialien in Pharmaqualität führen zu minimalen Rückständen und geringsten Spuren von Schwermetallen. Actril® Cold Sterilant wird zur manuellen Desinfektion von Arbeitsflächen und Geräten eingesetzt und kann in Verbindung mit einem Reinigungsmittel verwendet werden, um eine höhere Wirkung bei Biofilmen zu erzielen. Das Minncare® Cold Sterilant wird zur Sterilisation von medizinischen Geräten sowie zur Desinfektion von qualitativ hochwertigen und sensiblen Wasseraufbereitungsanlagen eingesetzt und ist in Verbindung mit der Minncare® Dry Fog™-Technologie auch zur aerosolbasierten Desinfektion von Reinräumen zugelassen.
Das Minncare® Dry Fog™-Konzept
Minncare® Dry Fog™ bietet seit nunmehr zehn Jahren ein sehr gutes und einzigartiges Konzept zur Desinfektion von Oberflächen in anspruchsvollen Bereichen.
Das autoklavierbare System erzeugt einen Nebel aus äußerst feinen Tröpfchen mit einem exakten Durchmesser von 7,5 Mikron. Die Tröpfchen perlen von den Oberflächen ab, ohne diese wirklich zu befeuchten (Trockennebeleffekt), und die Minncare®-Dampfphase verteilt sich rasch und effektiv im gesamten Raum. Die Größe der Tröpfchen stellt hierbei den zentralen Faktor dar: Größere Tröpfchen würden nicht lange genug in der Luft verbleiben, um sachgemäß zu dispergieren und würden zu Lachen kondensieren, wodurch das Risiko für Korrosion ebenso wie die Trockendauer ansteigen würde. Zu kleine Tröpfchen hingegen könnten in die Farbschichten von Wänden oder Geräten eindringen und diese dauerhaft beschädigen.
Mittels einer einfachen Druckluftquelle erzeugt das System Dämpfe, die weder die Flüssigkeit erhitzen noch den Einsatz eines sehr komplexen oder computergesteuerten Geräts erfordern.
Das Minncare®-Trockennebelkonzept ist gleichbedeutend mit einer einfachen Anwendung, Wartung und Überprüfung. Das System ist flexibel einsetzbar für Raumvolumina von 20 bis 1.000 Kubikmeter. Auch kann ein einzelnes System zur Desinfektion eines Bereichs mit mehreren Räumen mit einer Vorlaufzeit von wenigen Stunden anstatt ganzer Tage verwendet werden.
Das Minncare® Dry Fog™ wurde gemeinsam mit Unternehmen für den Einsatz in der pharmazeutischen Industrie und in Hinblick auf die Dokumentation, Zertifizierung, Qualifikation und Nachverfolgbarkeit gemäß in der Pharmabranche geltenden Standards entwickelt. Über 600 dieser Systeme wurden bislang in FDA-geprüften pharmazeutischen Produktionseinrichtungen weltweit installiert.
Fallstudien
Ausgewählt wurden zwei repräsentative Fälle aus Hunderten von Nutzern in sterilen pharmazeutischen Einrichtungen, pharmazeutischen Versuchslaboren, Biotechnologie-Produktionsstätten und -Laboren, Produktionsstätten für medizinische Geräte und anderen kontrollierten Produktionsumgebungen.
Fallstudie 1: Eignung des Minncare® Dry Fog™ für einen Reinraum für die pharmazeutische Produktion
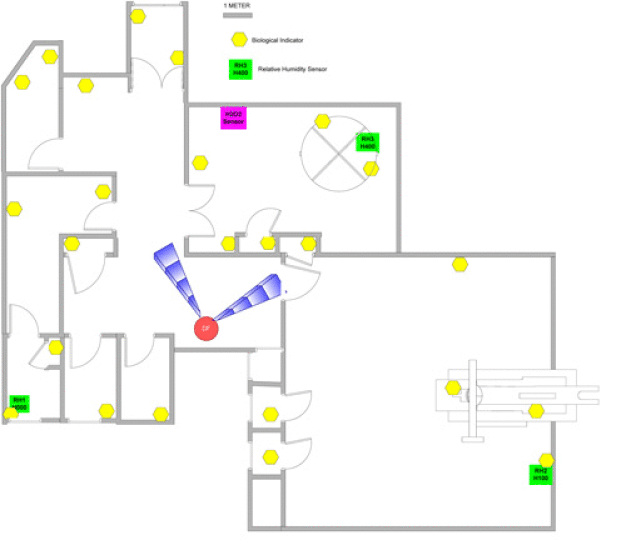
Bereich (Abb. 1):
Ein Bereich mit neun Räumen (Klasse A, B und C) mit einem Gesamtvolumen von 653 Kubikmetern. Die Räume sind vollständig mit Standardgeräten eingerichtet: Abfüllanlagen, Wagen, Schränke und verschiedene Instrumente.
Aufbau des Minncare® Dry Fog™-Systems:
Ein Minncare® Dry Fog™ mit zwei Vernebelungsdüsen ist an einer strategischen Stelle installiert, sodass es in zwei Richtungen sprühen und die Dämpfe gleichmäßig verteilen kann.
Diffundierte Lösung:
- Auf der Basis der vorformatierten Minncare® Dry Fog™-Excel-Berechnungstabelle und bei einer relativen Luftfeuchtigkeit von 35 % zu Beginn betrug die eingesetzte Menge von Minncare® 1.345ml verdünnt in 10.094ml WFI-Wasser.
- Diffusionsdauer: 122 Minuten
- Kontaktdauer: 60 Minuten
- Belüftungsdauer: 50 Minuten
- Gesamtdauer des Vorgangs: 232 Minuten oder weniger als vier Stunden.
Kontrolle der Dampfdesinfektion:
An verschiedenen Positionen im Raum wurden 6-log-Stufen-Bioindikatoren von B. atrophoeus (subtilis) (Apex Edelstahlträger in einer Tyvek®-Hülle) aufgestellt (gelbe Punkte in Abb. 1).
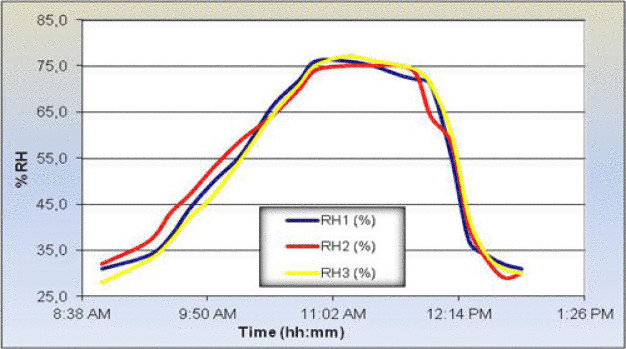
Drei Messsensoren für die relative Luftfeuchtigkeit an drei verschiedenen Stellen messen die relative Luftfeuchtigkeit im Bereich während des gesamten Desinfektionsvorgangs. Die Kurven der relativen Luftfeuchtigkeit geben die Dispersion der Dämpfe an (Abb. 2).
Abweichend von üblichen Prozessen wird zusätzlich ein H2O2-Sensor zur Messung der H2O2-Konzentration während des Vorgangs eingesetzt.
Kontrolle der Chemikalienrückstände:
Nach der Desinfektion konnte die Konzentration des verbliebenen H2O2 und der Peressigsäure in der Luft unkompliziert mittels des Dry Fog™-Dampferkennungssets sowie eines tragbaren elektronischen H2O2-Messgeräts gemessen werden.
Ergebnisse nach weniger als vier Stunden Desinfektionsdauer einschließlich Belüftung:
Mikrobiologie: Sämtliche Bioindikatoren waren nach sieben Tagen Inkubation negativ, wodurch eine Verringerung der Keimbelastung um 6-log-Stufen an jedem Standort bestätigt wurde.
Rekondensation: Eine Rekondensation wurde lediglich am Boden in der Nähe des Diffusionsgeräts festgestellt. Im übrigen Bereich betrug die maximale relative Feuchtigkeit 75% und war niedriger als der Taupunkt.
Maximale H2O2-Konzentration: Im gemessenen Bereich betrug diese 102ppm. Dies belegt, dass selbst mit einer Dispersion von nur sehr geringen Mengen von Chemikalien eine Wirkung erzielt werden kann, ohne dass sich die sonst damit verbundenen Probleme von Korrosion und Rückständen ergeben.
Korrosion: Es wurden nirgendwo Spuren von Korrosion festgestellt, weder auf großen Oberflächen noch auf den Geräten und Instrumenten.
Rückstände: Es wurden keine Rückstände auf den Oberflächen festgestellt. Zum Zeitpunkt, an dem die Mitarbeiter den Raum betraten, um die Bioindikatoren aus dem Gerät zu entnehmen, belegten die Kontrollen in der Luft Konzentrationen von weniger als 1ppm H2O2 und 10ppm Peressigsäure. Nach der Desinfektion müssen die Oberflächen weder gereinigt noch abgewischt werden.
Fallstudie 2: Unkontrollierbares Kontaminationsproblem in einem pharmazeutischen Produktionsbereich
Standort:
Neue Reinraum-Einrichtung in Südeuropa, 212 Quadratmeter
Problem:
Räume der Klasse A, B und C befinden sich aufgrund einer persistierenden mikrobiologischen Kontamination außerhalb der vorgeschriebenen Spezifikationen. Identifizierter Mikroorganismus: Chrysonilia Sitophila.
Vorgeschichte:
Die Mitarbeiter vor Ort und externe Dienstleistungsunternehmen führten verschiedene Maßnahmen mit unterschiedlichen Technologien zur biologischen Dekontamination durch, jedoch ohne nennenswerten Erfolg:
- Manuelle Oberflächendesinfektion: 4 verschiedene Biozidprodukte mit verschiedenen Formulierungen einschließlich Isopropylalkohol und Chlor.
- Biologische Dekontamination über die Luft:
- 30-50%-iges Formaldehyd: Die verbliebene mikrobiologische Kontamination ist immer noch höher als für eine Neueinstufung erlaubt
- Ozon: Drei Mal bei den Räumen sowie bei der gesamten Belüftungsanlage: Die Kontamination kam nach einer Woche zurück
- Vaporisiertes 33 %-iges Wasserstoffperoxid: Die Wirkung reichte für eine Neueinstufung des Bereichs nicht aus.
Die Situation schien ausweglos, nach den enormen Ausgaben für die biologische Dekontamination war keine erfolgversprechende Lösung in Sicht.
Untersuchung durch Mar Cor Purification:
Zur Einschätzung der Situation und zur Erkennung möglicher Kontaminationsquellen wurde eine Begutachtung durchgeführt. Es wurde festgestellt, dass eine im Norden liegende benachbarte Fabrik Holzmöbel herstellt. Die neue Reinraum-Einrichtung befand sich während des Sommers im Bau. Die Wetterbedingungen lagen bei Temperaturen von ca. 35 °C und bei 80 % relativer Luftfeuchtigkeit. Darüber hinaus blies in dieser Zeit ein starker Wind von Norden. Und ein letzter Punkt: Die vorhandenen HEPA-Filter bestehen aus Zellulose. Alle diese Punkte führten zu einer Rekonstruktion der Tatsachen: Die neue Reinraum-Einrichtung wurde während ihres Baus durch das benachbarte Unternehmen kontaminiert. Sie wurde vollständig durch Holzstaub verunreinigt. Der Schimmelpilz Chrysonilia Sitophila kommt von Holz und konnte sich bestens aus den aus Zellulose bestehenden HEPA-Filtern ernähren.
Maßnahme:
Manuelle Desinfektion mit Actril®Cold Sterliant:
Mit der zweifach verpackten Reinraum-Version von Actril wurde jeder schwer zugängliche Bereich systematisch von Hand besprüht: Wand-/Deckenecken, Geräte- und Tischfüße auf dem Boden, Bereiche um die Türen, sowie jeder einzelne zugängliche HEPA-Filter.
Biologische Dekontamination über die Luft:
Mit dem Minncare® Dry Fog™ wurde jeder Raum systematisch bedampft. Dabei wurde das Verfahren so angepasst, dass sichergestellt war, dass die Dämpfe auch in einer entsprechenden Konzentration durch die gesamte Belüftungsanlage gingen, einschließlich jedes einzelnen HEPA-Filters. Das Minncare® Dry Fog™-Verfahren wurde zweimal wiederholt.
Ergebnisse:
Der Mikrobiologe vor Ort bestätigte einige Tage später, dass sämtliche Tests negativ ausgefallen waren, und auch einige Wochen später war keine erneute Kontamination festzustellen. Die Räume erfüllten offiziell die Vorschriften und wurden neu eingestuft.
Schlussfolgerung
Die Peressigsäure-Technologie bietet eine gute und sichere Lösung zur Desinfektion von Reinräumen in sterilen Einrichtungen der pharmazeutischen Industrie. Sie kann in einer gebrauchsfertigen Form für das manuelle Abwischen und Besprühen von Oberflächen eingesetzt werden. Die Technologie kann auch in Verbindung mit dem biologischen Dekontaminationssystem Minncare® Dry Fog™ für eine Desinfektion über die Luft angewendet werden.
In jedem Fall erfüllt die PES-Technologie die Anforderungen der FDA und USP bezüglich der Wirkung und der periodischen Zerstörung von Bakteriensporen.
Nicht zuletzt kann Peressigsäure in sehr geringen Konzentrationen angewendet werden und bei sachgemäßem Umgang ist es für die Anwender, Oberflächenmaterialien, Geräte und die Umwelt vollkommen sicher.
Hunderte von Anwendern aus der Pharmabranche haben dies selbst ausprobiert und wenden diese Technologie täglich an.
(1) Guidance For Industry, Sterile Drug Produced by Aseptic Processing Current Good Manufacturing Practice September 2004 Pharmaceutical CGMPs Section x.
Laboratory Controls Part A. Environmental Monitoring Point 3. Wirksamkeit der Desinfektion.
![]()
VWR International GmbH
Hilpertstraße 20a
64295 Darmstadt
Germany
Phone: + 49 6151 39720
email: info.de@vwr.com
Internet: https://de.vwr.com