Carol Bartnett, Jim Polarine, Tom Smith, Dan Klein und Peter Karanja
Fungizide Wirkung von weltweit akzeptierten quartären Ammonium-Desinfektionsmitteln
ABSTRAKT
Quartäre Ammoniumverbindungen (QAV) sind hervorragende Wirkstoffe in Produkten zur Desinfektion, da sie eine geringe Toxizität, eine gute Reinigungsaktivität und eine bakterizide Wirksamkeit aufweisen. Leider sind viele der heute auf dem Markt erhältlichen QAV-Produkte unverträglich mit einigen Sterilisations-methoden und weisen eine unzureichende fungizide Wirkung auf. Diese Nachteile können dazu führen, dass der Einsatz von QAV-Desinfektionsmitteln in Reinräumen nach ISO-5 vermieden wird. Außerdem werden einige QAV in manchen europäischen Ländern nur eingeschränkt bei Behörden akzeptiert. Die hier beschriebenen Studien führen den Nachweis, dass ein Produkt, das Didecyldimethylammoniumchlorid (einer QAV) enthält, Wirkung gegen Pilzgenotypen, z. B. Aspergillus brasiliensis aufweist, unter Bestrahlung stabil ist und weltweite Normen zur Umweltverträglichkeit einhält.
EINFÜHRUNG
Quartäre Ammoniumverbindungen wurden als Wirkstoffe in Desinfektionsmitteln für harte Oberflächen seit den 30er Jahren des vergangenen Jahrhunderts eingesetzt, und mittlerweile sind Hunderte von Varianten davon erhältlich. Diese Verbindungen sind folgendermaßen aufgebaut: Um ein positiv geladenes Stickstoffatom gliedern sich vier organische Gruppen (1). Im Verlauf der Jahre wurden verschiedene QAV entwickelt, die alle unterschiedliche Kombinationen von an das Stickstoffatom gebundenen Alkyl- und aromatischen Gruppen aufweisen. Diese Rezepturen werden jetzt weltweit verwendet (2).
Ein wichtiger Faktor, der die Auswahl einer QAV für eine Desinfektionsmittelrezeptur beeinflusst, ist die Frage der Akzeptanz der QAV durch die entsprechenden
Kontrollorgane, z. B. der United States Environmental Protection Agency (EPA) und der Richtlinie des Europäischen Parlaments über das Inverkehrbringen von Biozid-Produkten (Biozid-Richtlinie). Die Anzahl von QAV, die bei der EPA registriert sind und in der Biozid-Richtlinie aktiv unterstützt werden, ist relativ klein. Es zählen nur die QAVWirkstoffe wie Didecyldimethylammoniumchlorid und Alkyldimethylbenzylammoniumchlorid (3,4) dazu. Dies kann die Auswahl eines
quartären Ammonium-Desinfektionsmittels zu einem schwierigen Unterfangen für internationale Pharmakonzerne machen, die Interesse an der Vereinheit-lichung von global geltenden Arbeitsvorschriften haben. Diese Herausforderung wird noch größer, wenn es gilt, ein Desinfektionsmittel für den Einsatz in einer kontrollierten Umgebung auszuwählen.
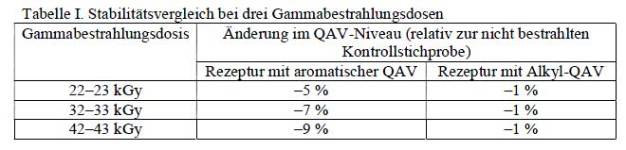
Produkte zur Desinfektion müssen vor ihrem Einsatz im Reinraum sterilisiert werden (5). Eine Methode zur Sterilisation des Produkts und seiner Verpackung besteht in der Bestrahlung mit Gammastrahlen. QAV mit Alkylgruppen haben den Nachweis erbracht, dass sie eine bessere Stabilität bei Gammabestrahlung als QAV mit aromatischen Gruppen aufweisen. Wird eine aromatische QAV der Gammabestrahlung ausgesetzt, kann sich die Bindung zwischen dem Stickstoffatom um dem aromatischen Teil des Moleküls lösen, wodurch sich als Nebenprodukte Amine bilden können. In Tabelle I wird die Stabilität einer aromatischen QAV-Rezeptur unter Gammabestrahlung mit der Stabilität einer Alkyl-QAV-Rezeptur verglichen. Die Zersetzung der Alkyl-QAV durch die Bestrahlung mit Gamma-strahlen ist minimal, während die Zersetzung der aromatischen QAV erheblich ist und mit zunehmender Bestrahlungsdosis zunimmt (6). (Siehe Tab. I)
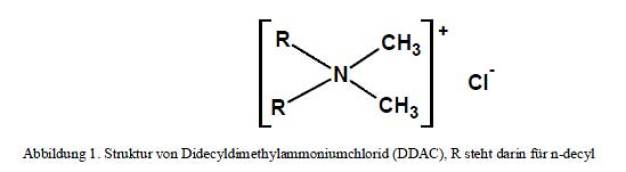
Beim Abwägen der regulatorischen Kriterien gegen die gewünschte Bestrahlungsstabilität ist Didecyldimethylammoniumchlorid die beste Wahl unter allen
verbleibenden QAV, die für eine weltweit einsetzbare Desinfektionsmittelrezeptur in Frage kommen. (Siehe Abb. 1)
Obwohl Didecyldimethylammoniumchlorid Anforderungen an eine weltweite Verwendung erfüllt, fehlt für einige QAV-Rezepturen das breite Wirkungsspektrum. Auf der einen Seite erbringen einige QAV-Produkte den Nachweis bakterizider und viruzider Wirkung, auf der anderen Seite fehlt ihnen aber die erforderliche Wirksamkeit bei bestimmten Arten von Pilzen aufgrund verschiedener Mechanismen der spezifischen Resistenz und der Beschaffenheit von Pilzsporen, die resistenter gegen die Desinfektion sind (7). Die Folgen eines Pilzbefalls können erheblich sein und zu langfristigen Problemen in einem Betrieb führen. In Warnschreiben und Mängelberichten (Form 483) der FDA (Food and Drug Administration) werden häufig unzureichende Maßnahmen gegen einen Pilzbefall und die fehlende Gewähr dafür aufgelistet, dass die in einer Einrichtung verwendeten Desinfektionsmittel wirksam gegen Pilze sind (8,9).
Ein bestimmter Pilzgenotyp, Aspergillus brasiliensis ATCC 16404 (der früher unter dem Namen Aspergillus niger ATCC 16404 bekannt war), hat sich als schwierige Herausforderung für Pharmaunternehmen erwiesen und wird von den meisten QAV-basierten Desinfektionsmitteln nicht erreicht (10). In vielen Fällen werden Sporizide und Desinfektionsmittel wie Bleiche (Natriumhypochlorit), Wasserstoffperoxid, Peressigsäure, Chlordioxid, Ozon, Glutaraldehyd, Iod und Phenole in Anwendungen verwendet, bei denen eine Wirksamkeit gegen Aspergillus brasiliensis gefordert ist. Die Verwendung einiger dieser Verbindungen kann jedoch Sicherheits-, Umwelt-, Geruchsoder Verfärbungsprobleme mit sich bringen. Ein QAV-basiertes Desinfektionsmittel mit anerkannten Wirkungs-aussagen in Bezug auf Aspergillus brasiliensis stellt für Anwender eine gesicherte Alternative für diesen Anwendungsbereich dar.
Bei der Rezeptur eines QAV-basierten Desinfektionsmittels können Inhaltsstoffe wie eine Alkaliquelle, ein Komplexbildner, ein Zusatzlösungsmittel oder ein Tensid ausgewählt werden, um die Wirkung einer auf Didecyldimethylammoniumchlorid basierenden Rezeptur zu verbessern. Diese Inhaltsstoffe erfüllen auch die Bedingungen der REACh-Verordnung (REACh steht für Registration, Evaluation, Authorization and Restriction of Chemicals, also für die Registrierung, Bewertung, Zulassung und Beschränkung von Chemikalien) (11). Die Einhaltung dieser Verordnung für alle in der Europäischen Union vertriebenen Rezepturen obligatorisch ist.
Die in diesem Artikel beschriebenen Tests wurden für eine Rezeptur durchgeführt, die auf Didecyldimethylammoniumchlorid basiert. Dabei wurde die Rezeptur gegen verschiedene Pilzgenotypen unter Anwendung von europäischen und USamerikanischen, von der EPA zugelassenen Methodiken getestet.
MATERIALIEN UND METHODEN
Für Wirksamkeitstests zu den Etikettaussagen von US-amerikanischen bzw. europäischen Desinfektionsmitteln ist eine strikte Einhaltung der entsprechenden Standardmethoden erforderlich, die von den zuständigen Behörden anerkannt werden. Die Verfahren werden wie folgt zusammengefasst.
BS EN 1650-Methode (12)
Zubereitung der Testkeime. Es wurden Suspensionen von Candida albicans ATCC 10231 und Aspergillus brasiliensis ATCC 16404 zubereitet und so eingestellt, dass sie ca. 1,5–5,0 x 107 KbE/ml ergeben. Es wurden serielle zehnfache Verdünnungen hergestellt, um die Anzahl der KBE (koloniebildende Einheiten) pro ml in der Inokulumsuspension zu verifizieren.
Testverfahren. Ein Aliquot des Desinfektionsmittels, das in hartem Wasser mit 300 ppm Kalziumkarbonat (CaCO3) verdünnt wurde, wurde in ein Röhrchen gegeben, in dem die Störsubstanz und eine fungizide Suspension enthalten waren, und bei 20 ±1 °C über die angegebene Kontaktzeit in dem Röhrchen belassen. Nach Ablauf der Kontaktzeit wurde 1,0 ml der Testmischung in die Neutralisationslösung gegeben. Nach einer Neutralisationszeit von 5 Minuten ±10 Sekunden wurde eine 1,0-ml-Probe jedes neutralisierten Gemischs auf eine sterile Petrischale gegeben. Geschmolzenes Malzextrakt-Agar (MEA) wurde auf jede Petrischale verteilt. Nach der Inkubation wurden alle Platten gezählt und der KBE/ml-Wert der Testmischung errechnet. Während des in BS EN 1650 beschriebenen Testverfahrens erfolgten gleichzeitig eine Validierung und entsprechende Kontrollen.
BS EN 13697-Methode (13)
Zubereitung der Testkeime. Es wurden Suspensionen von Candida albicans ATCC 10231 und Aspergillus brasiliensis ATCC 16404 zubereitet und so eingestellt, dass sie ca. 1,5–5,0 x 107 KbE/ml ergeben. Es wurden serielle zehnfache Verdünnungen hergestellt, um die Anzahl der KBE (koloniebildende Einheiten) pro ml in der Testsuspension zu verifizieren. Das Testinokulum wurde zubereitet, indem 1 ml jeder fungiziden Suspension zu 1 ml der Störsubstanz (3,0 Gramm BSA in 1 Liter destilliertem Wasser) gegeben und dies gut durchgemischt wurde.
Testverfahren. Saubere, trockene Edelstahlscheiben mit einem Durchmesser von zwei Zentimetern wurden in flache, sterile Einzelbehälter platziert. Die Testoberfläche wurde mit 0,05 ml des zubereiteten Testinokulums beimpft und bei 37 °C getrocknet, bis sie sichtbar trocken war. Ein Aliquot der Desinfektions-mittellösung wurde auf jede Testoberfläche platziert. Dabei wurde sichergestellt, dass das getrocknete Inokulum komplett abgedeckt wurde. Nach der festgelegten Einwirkzeit (5 min für C. albicans und 15 min für A. brasiliensis) wurden 10 ml der Neutralisationslösung hinzugefügt. Jeder Behälter wurde abgedeckt und 1 Minute lang gemischt, um alle verbleibenden Zellen/Sporen von den Oberflächen zu entfernen. Nach einer Neutralisationszeit von 5 min ±10 s wurde die neutralisierte Mischung seriell verdünnt, und es wurde eine 1,0-ml-Probe jeder Verdünnung in zweifacher Ausführung auf einzelne, sterile Petrischalen
gegeben. Anschließend wurde die geschmolzene MEA hinzugegeben. Die Testoberfläche wurde herausgeholt, mit 10 ml destilliertem Wasser abgespült und mit der Testseite nach oben weisend auf eine Petrischale gelegt, auf der sich ca. 10 ml des verfestigten MEA befand. Ein Aliquot des sterilen, destillierten Wassers wurde auf die Scheibe gegeben, und die Oberfläche wurde mit einem sterilen Spachtel 1 Minute lang abgeschabt, um Rückstände von getrocknetem Inokulum von der Oberfläche der Platte zu entfernen. Weitere 10 ml der geschmolzenen MEA wurden über die Scheibe gegossen. Nach der Inkubation wurden alle Platten ausgezählt und die Anzahl koloniebildender Einheiten notiert. Während des in BS EN 13697:2001 beschriebenen Testverfahrens erfolgten gleichzeitig Validierungstests und -kontrollen.
Fungizide Methodik nach AOAC (14)
Zubereitung der Testkeime. Pilzkulturen von Aspergillus brasiliensis ATCC e 16404, Aspergillus niger ATCC 6275 und Trichophyton mentagrophytes ATCC 9533 wurden in Neopepton-Glucose-Agar (NGA) bei 25–30 °C über 7 bis 10 Tage vermehrt. Die Myzelmatten wurden aus der Agaroberfläche gelöst und mit Kochsalzlösung in einem sterilen Glasgewebe-Zerkleinerer aufgeweicht. Anschließend erfolgte eine Filtration über sterile Glaswolle. Die endgültigen Inokula wurden durch Hinzugabe der entsprechenden Menge an Fetal Bovine Serum, FBS (Fötales Kälber Serum, FKS) zu jeder Kultur zubereitet, um so eine 5-prozentige Mischung zu erhalten. Die Dichte jeder Konidiensuspension wurde mittels Plattenzählverfahren ermittelt. Vor dem Gebrauch wurden die jeweiligen Suspensionen mithilfe von Kochsalzlösung normiert, sodass etwa 5,0 x 106 Konidien/ml produziert wurden.
Testverfahren. Für jeden Testkeim wurden zwei 25 x 150 mm große Teströhrchen mit einem Inhalt von 5 ml, die jede Charge der Testsubstanzen repräsentierten, auf eine Temperatur von 20 ±2 °C eingepegelt. Eine Menge von 0,5 ml des normierten, filamentösen fungiziden Inokulums wurde jedem Röhrchen beigegeben und geschwenkt. Nach einer Kontaktzeit von 10 Minuten bei 20 ±2 °C wurde eine Probe aus dem Röhrchen mithilfe einer 4 mm breiten mikrobiologischen Schlinge in 10 ml des entsprechenden Neutralisiermittels überführt. Der Vorgang wurde für alle Röhrchen wiederholt. Entsprechende Kontrollen wurden auch gemäß Beschreibung in der offiziellen AOAC-Methode 955.17 „Fungicidal Activity of Disinfectants“ durchgeführt. Nach jedem Transfer wurden die Röhrchen gründlich geschüttelt, und alle Röhrchen wurden 7 bis 10 Tage lang bei 25–30 °C inkubiert. Nach der Inkubation wurden die Röhrchen auf das Vorhandensein oder Fehlen von Wachstum untersucht.
Methode „Abtötungszeit“
Zubereitung der Testkeime. Eine Pilzkultur von Aspergillus brasiliensis ATCC 16404 wurde auf einem Sabouraud-Dextrose-Schrägagar (SDA) 7 bis 10 Tage lang bei 25–30 °C gezüchtet. Das Mikroben-Arbeitsnährmedium wurde zubereitet, indem die Myzelmatten aus der Agaroberfläche gelöst und mit Kochsalzlösung in einem sterilen Glasgewebe-Zerkleinerer aufgeweicht wurden.
Testverfahren. Eine Menge von 0,1 ml des Arbeitsnährmediums wurde in 9,9 ml des Desinfektionsmittels verbracht. Nach einer Kontaktzeit von 1, 5 und 10 Minuten wurde eine 0,1-ml-Probe aus dem Röhrchen in 10 ml der Neutralisationslösung überführt. Anschließend wurden serielle zehnfache Verdünnungen hergestellt, plattiert und mit SDA begossen. Die Platten wurden 5–7 Tage bei 30 °C inkubiert. Die Kontrollen wurden in derselben Weise durchgeführt, allerdings wurde statt Desinfektionsmittel ein Puffer verwendet. Die log10-Werte der KBE/ml-Daten wurden für Kontrollen und Textgegenstände aus dem Test berechnet. Die log10-Reduktionswerte stellen die Differenz zwischen den mittleren log10-Kontrollwerten und den log10-Werten der Testgegenstände dar.
ERGEBNISSE UND DISKUSSION
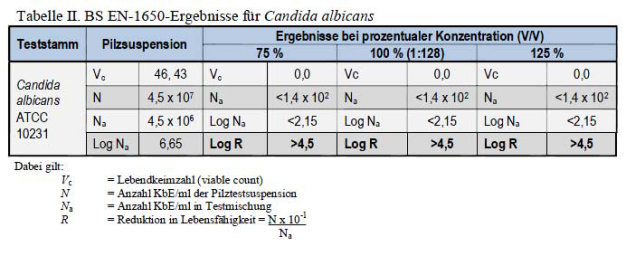
Der BS EN-1650 ist ein quantitativer Suspensionstest, der zur Beurteilung der fungiziden Wirkung von Desinfektionsmitteln verwendet wird. Da die Testbe-dingungen repräsentativ für einen praktischen Gebrauch sind, kann diese Methode für generische Wirkungsaussagen zu Desinfektionsmitteln in vielen europäischen Ländern verwendet werden. Das Zulässigkeitskriterium für den Test beträgt ≥ 4 log10 Reduktion von Lebendkeimzahlen (Log R). In Tabelle II wird gezeigt, dass das in hartem Wasser mit einem Verhältnis von 1:128 verdünnte und unter verschmutzten Bedingungen bei 20 ±1 °C getestete Testprodukt einen Log R über 4,5 erreichte und somit eine fungizide Wirkung gegen Candida albicans ATCC 10231 über 5 Minuten bewiesen hat. In Tabelle III wird gezeigt, dass das in hartem Wasser mit einem Verhältnis von 1:32 verdünnte und unter verschmutzten Bedingungen bei 20 ±1 °C getestete Testprodukt einen Log R über 4,6 erreichte und somit eine fungizide Wirkung gegen Aspergillus brasiliensis ATCC 16404 über 15 Minuten bewiesen hat.
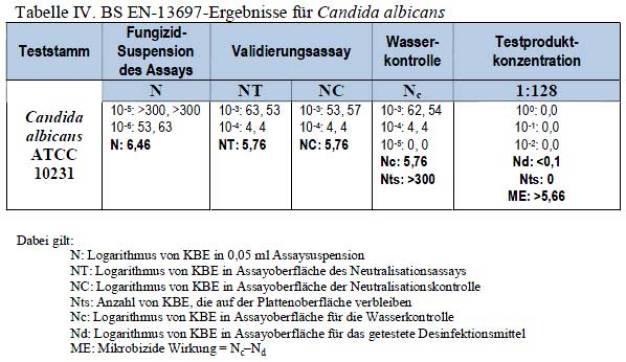
Der BS EN 13697 ist ein quantitativer Oberflächentest, der zum Nachweis dient, dass Produkte eine mikrobizide Wirkung gegen Mikroorganismen haben, die sich an Oberflächen anheften. Das Zulässigkeitskriterium für fungizide Wirkung beträgt ≥ 3 log10 Reduktion; der Wert wird als mikrobizide Wirkung (ME-Wert) berechnet. In Tabelle IV wird gezeigt, dass das in hartem Wasser mit einem Verhältnis von 1:128 verdünnte und unter schmutzigen Bedingungen (3 g/l BSA) bei 20 ±1 °C getestete Testprodukt einen ME-Wert über 5,66 erreichte und somit eine fungizide Wirkung gegen Candida albicans ATCC 10231 über 15 Minuten bewiesen hat.
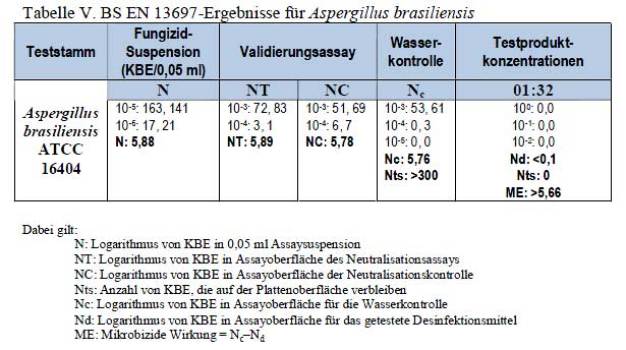
In Tabelle V wird gezeigt, dass das in hartem Wasser mit einem Verhältnis von 1:32 verdünnte und unter verschmutzten Bedingungen (3 g/l BSA) bei 20 ±1 °C getestete Testprodukt einen ME-Wert über 5,66 erreichte und somit eine fungizide Wirkung gegen Aspergillus brasiliensis ATCC 16404 über 15 Minuten bewiesen hat.
In den Vereinigten Staaten wird die fungizide Wirkung mittels der offiziellen AOAC-Methode 955.17 „Fungicidal Activity of Disinfectants“ ermittelt. Ergebnisse haben gezeigt, dass das Testprodukt nach einer Einwirkzeit von 10 Minuten wirksam gegen Trichophyton mentagrophytes ATCC 9533 und Aspergillus niger ATCC 6275 war, wenn es im Verhältnis 1:128 in 400 ppm hartem Wasser verdünnt und in Anwesenheit einer organischen Belastung durch 5-prozentiges Fetal Bovine Serum, FBS (Fötales Kälber Serum, FKS) mittels des AOAC-Tests auf fungizide Wirkung ohne beobachtetes Wachstum in einem der Testreplikate getestet wurde. Das Testprodukt bewies außerdem eine Wirksamkeit nach einer Einwirkzeit von 10 Minuten gegen Aspergillus brasiliensis ATCC 16404, wenn es im Verhältnis 1:64 in 400 ppm hartem Wasser verdünnt und in Anwesenheit einer organischen Belastung durch 5-prozentiges Fetal Bovines Serum, FBS (Fötales Kälber Serum, FKS) getestet wurde. Versuche haben belegt, dass Trichophyton mentagrophytes stärker auf das Desinfektionsmittel ansprach als Aspergillus brasiliensis ATCC 16404 (15).
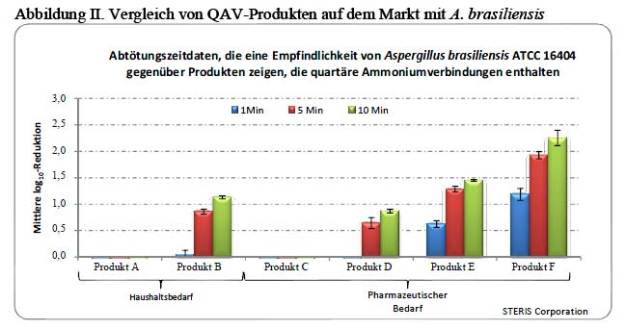
Die Basiswirkung von QAV enthaltenden Produkten auf Aspergillus brasiliensis ATCC16404 kann mithilfe eines Abtötungszeit-Suspensionstests ermittelt werden, wie Abbildung II zeigt. Die Produkte A und B sind einsatzbereite Haushaltsreiniger (QAV-Reiniger/-Desinfektionsmittel) und die Produkte C, D, E und F QAV-Desinfektionsmittel für den pharmazeutischen Bedarf. Produkt C enthält außerdem ein Biguanid.
Die Ergebnisse in Abbildung II beweisen die Wichtigkeit einer ordnungsgemäßen Rezeptur bei der Entwicklung von QAV-Desinfektionsmitteln. Ein signifikanter Unterschied kann insofern bei der Wirksamkeit gegen Aspergillus brasiliensis festgestellt werden, dass diese nicht direkt mit dem Wirkstofftyp, der Konzentration bzw. mit der praktischen Anwendung korreliert.
SCHLUSSBEMERKUNG
Der Gebrauch eines Desinfektionsmittels, das auf einer quartären Ammoniumverbindung beruht, bringt mehrere Vorteile mit sich. Unter anderem zählen dazu die hervorragende Reinigungsaktivität, die geringe Toxizität und bakterizide sowie viruzide Wirksamkeit. Allerdings bieten nicht alle Rezepturen mit quartären Ammoniumverbindungen die fungizide Wirkung von anderen Wirkstoffen, und die auf dem Markt erhältlichen QAV haben möglicherweise sehr unterschiedliche Entwicklungsstände, was die Wirkung gegen Pilzsporen angeht. Ein richtig formuliertes QAV-basiertes Desinfektionsmittel kann jedoch eine Wirkung gegen anspruchsvolle Pilzarten wie Aspergillus brasiliensis entfalten, ohne dass dabei Abstriche bei anderen wichtigen Eigenschaften wie den weltweit akzeptierten Inhaltsstoffen, der Umweltverträglichkeit und der Bestrahlungsstabilität in konzentrierter Form hingenommen werden müssen.
LITERATURHINWEISE
1. M. Cucci. Soap and Sanitary Chemicals. 25, 129-134,145 (1949).
2. P. Schaeufele. J. Assoc. Ocs. 61, 387-389 (1984).
3. U. S. Environmental Protection Agency, Substance Registry Services, http://iaspub.epa.gov/sor_internet/registry/substreg/searchandretrieve/substancesearch/search.do, accessed July 13, 2011.
4. Regulation (EC) No. 2032/2003. List of participants/applicants to the Review Programme of existing active substances used in biocidal products, http://ec.europa.eu/environment/biocides/pdf/list_participants_applicants_subs.pdf, accessed July 13, 2011.
5. FDA Guidance for Industry, Sterile Drug Products Produced by Aseptic Processing – Current Good Manufacturing Practice, U.S. Department of Health and Human Services, Food and Drug Administration, September 2004.
6. Interne Daten der STERIS Corporation, unveröffentlicht.
7. McDonnell, G.E. “Antisepsis, Disinfection, and Sterilization: Types, Action, and Resistance,” ASM Press, Washington, DC, 2007.
8. U.S. Food and Drug Administration, Inspections, Compliance, Enforcement, and Criminal Investigations, Medimmune, Inc. Warning Letter, May 27, 2007, http://www.fda.gov/ICECI/EnforcementActions/WarningLetters/2007/ucm076398.htm, accessed May 9, 2011.
9. GMP Trends Inc., Issue 766, December 15, 2008.
10. Polarine, J., Macauley, J., Karanja, P., Klein, D., Martin, A., “Evaluating the Activity of Disinfectants Against Fungi,” Cleanrooms: The Magazine of Contamination Control Technology, 23 (2), February 2009.
11. Regulation (EC) No 1907/2006 of the European Parliament and of the Council of 18 December 2006 concerning the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACh), establishing a European Chemicals Agency, amending Directive 1999/45/#C and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC, http://eurlex.europa.eu/LexUriServ/LexUriServ.do?uri=CELEX:32006R1907:EN:NOT, accessed July 11, 2011.
12. BS EN 1650:2008. Chemical disinfectants and antiseptics – Quantitative suspension test for the evaluation of fungicidal activity of chemical disinfectants and antiseptics used in food, industrial, domestic and institutional requirements (phase 2, step 1). Available from British Standards Institute (BSI), 389 Chiswick High Rd., London W4 4AL, U.K., http://www.bsi-global.com.
13. BS EN 13697:2001. Chemical disinfectants and antiseptics – Quantitative non-porous surface test for the evaluation of bactericidal and/or fungicidal activity of chemical disinfectants used in food, industrial, domestic, and institutional areas – Test method and requirements without mechanical action (phase 2/step 2). Available from British Standards Institute (BSI), 389 Chiswick High Rd., London W4 4AL, U.K., http://www.bsi-global.com.
14. AOAC Official Method 955.17 “Fungicidal Activity of Disinfectants,” Official Methods of Analysis of the AOAC, Eighteenth Edition, AOAC International, 2005.
15. Interne Daten der STERIS Corporation, unveröffentlicht.
STERIS Deutschland GmbH
50933 Köln
Germany